ЛАБОРАТОРНЫЕ И ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
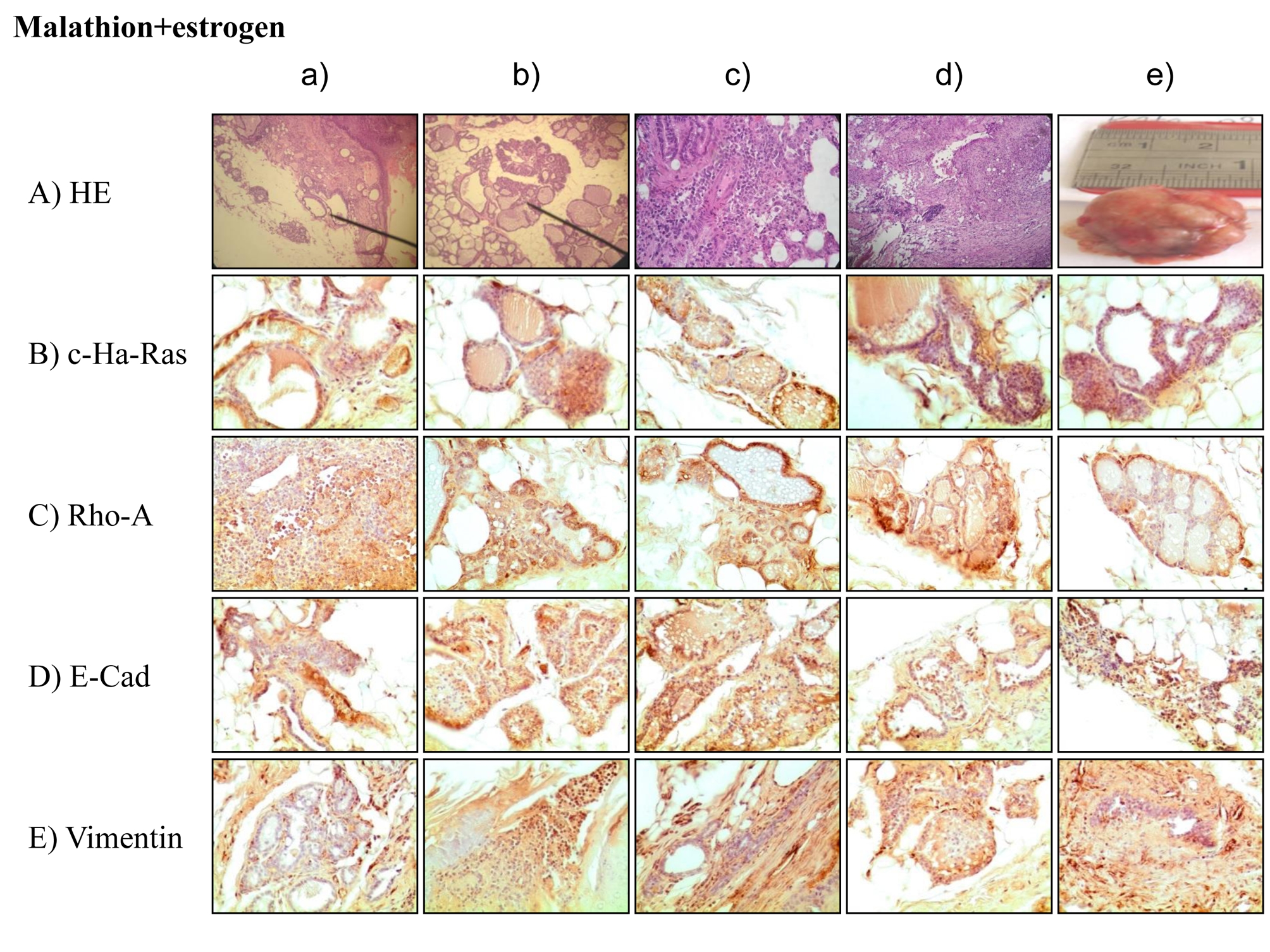
Рак молочной железы является самой распространенной злокачественной опухолью среди женщин как в развитых, так и в развивающихся странах. Этиология рака молочной железы всё еще остается не до конца изученной. Химические вещества, такие как фосфорорганическое соединение – малатион (карбофос), используемый для борьбы с вредителями растений, являются этиологическими факторами для рака молочной железы. Связь между инициацией рака молочной железы и длительным воздействием эстрогена позволяет предпологать, что этот гормон может также играть этиологическую роль в этом процессе. Тем не менее ключевые факторы, лежащие в основе формирования рака молочной железы, еще предстоит установить. Влияние таких субстанций, как малатион и эстроген, анализировалось в экспериментальной модели молочной железы у крыс. Различные цитоплазматические белки играют ключевую роль в превращении нормальной клетки в злокачественную, и среди них есть семейство Ras-super и Ras- гомологичный A (Rho-A). Уровень этих белков был выше у животных, получавших малатион, чем у животных, получавших эстроген. E-кадгерины составляют большое семейство мембранных белков.
Результаты исследования показали, что экспрессия E-кадгерина и виментина была выше, чем экспрессия белков c-Ha-ras и Rho-A у крыс, получавших эстрогены. При раке молочной железы иммуногистохимический анализ является важным компонентом рутинных патологических исследований и играет существенную роль в диагностической и прогностической оценке тяжести заболевания.
Целью настоящего исследования было выявление прогностических маркеров для пациентов с раком молочной железы.
Дендритные клетки (ДК) – это специализированная группа антиген-презентирующих клеток с высокой функциональной пластичностью, которые проявляют иммуностимулирующий или иммуносупрессивный потенциал в зависимости от последовательности и комбинации стимулов микроокружения, определяющих их дифференцировку, созревание, активацию. Разработка противоопухолевых ДК-вакцин основана на способности ДК специфически активированных in vitro мигрировать для презентации антигенов Т-лимфоцитам in vivo. В работе проведено изучение элементов опухолевого микроокружения, способных оказывать влияние на миграцию ДК. Изучение подвижности ДК в экспериментальной аналитической системе Cell-IQ показало наличие обратной корреляции высокой силы между средней скоростью прохождения траектории ДК и содержанием иммуносупрессивных факторов (ИСФ) в супернатантах культивируемых клеток меланомы кожи (TGFβ1, IL-10, IL-18, VEGF-A, EGF, FGF, HGF, sFASL (p<0,01)). Была выявлена обратная зависимость высокой силы угла движения популяции ДК от экспрессии раково-тестикулярных антигенов (РТА) и других опухолеассоциированных антигенов (ОАА) на опухолевых клетках: Melan A, тирозиназы, семейств MAGE, BAGE, NY-ESO-1 (p<0,05). Скорость движения ДК в системе ко- культивирования с клетками меланомы №894 составила 30,10±2,23 мкм/ч и отличалась от таковой в присутствии 1 нг/мл IL-10 (10,45±0,52 мкм/ч), 10 нг/мл TGFβ1 (14,32±0,42 мкм/ч), 50 нг/мл VEGF (18,7±1,89 мкм/ч) (p<0,05). Можно предполагать, что содержание этих ИСФ в периферической крови больных является одним из факторов, определяющих клиническую эффективность противоопухолевой ДК-иммунотерапии.
С помощью DIC-микроскопии и конфокальной микроскопии были проанализированы изменения морфологии, миграционных характеристик и межклеточных адгезионных контактов в культуре клеток рака молочной железы MCF-7-SNAI1 при активации экспрессии транскрипционного фактора ЭМП – SNAI1. Как показал Вестерн-блот анализ, экспрессия SNAI1 достигала максимальных значений через 24 часа после переноса клеток в среду без тетрациклина и поддерживалась на этом уровне в течение семи дней. В клетках в течение семи дней сохранялась экспрессия Е-кадхерина, при этом тангенциальные межклеточные адгезионные контакты, характерные для клеток со стабильной межклеточной адгезией, замещались радиальными контактами. В радиальных контактах в течение 24–72 часов отмывки от тетрациклина продолжалась аккумуляция Е- кадхерина. В результате активации SNAI1 клетки вступали в ЭМП и приобретали миграционную активность. На двумерном субстрате клетки мигрировали как индивидуально, так и коллективно. С увеличением продолжительности отмывки от тетрациклина повышался процент клеток, мигрировавших через поры в миграционных камерах, способность клеток инвазировать эпителиальный монослой, напротив, снижалась. Полученные данные свидетельствуют о том, что сохранение гибридного эпителиально-мезенхимального фенотипа и аккумуляция Е-кадхерина в межклеточных адгезионных контактах на ранних этапах ЭМП не препятствуют разрушению стабильной межклеточной адгезии и приобретению клетками миграционной активности.
Специфическое блокирование амплификации аллеля дикого типа в ПЦР с помощью олигонуклеотидов, модифицированных по остатку рибозы (закрытые нуклеиновые кислоты, locked nucleic acids, LNA), используется для высокочувствительной детекции соматических мутаций в опухолях. Описаны различные версии метода анализа мутаций с использованием LNA-олигонуклеотидов как с дополнительной модификацией фосфотиоатными группами, так и без таких групп, при этом использовались различные ДНК полимеразы. В работе проведен анализ оптимальных условий для успешного специфического блокирования ПЦР с помощью LNA-олигонуклеотидов при анализе мутаций в генах KRAS и BRAF. Мы обнаружили, что фосфотиоатная защита на 5’-конце олигонуклеотидов не влияет на эффективность блокирования аллеля дикого типа. Выявлено, что для большинства последовательностей эффективное блокирование наблюдается при проведении шага отжига и элонгации ПЦР при температуре на 20–25°С ниже температуры плавления LNA-олигонуклеотида. При таких условиях реакции возможна простая и высокочувствительная детекция мутаций в генах KRAS и BRAF с использованием как секвенирования по Сэнгеру, так и ПЦР в реальном времени с Taqman зондами.
Участие экзосом в патогенезе злокачественных опухолей основано на их способности проникать внутрь клеток-реципиентов, вызывая в последних каскад генетических и эпигенетических изменений. Ранее мы показали, что экзосомы, продуцируемые различными вариантами эстроген-независимых сублиний клеток рака молочной железы (MCF-7/T, полученной в результате длительного культивирования клеток в присутствии антиэстрогена тамоксифена, и MCF-7/M, полученной в результате культивирования клеток с метформином), способны индуцировать резистентность в родительских клетках MCF-7. В настоящей работе для исследования характерных особенностей состава экзосом резистентных клеток был проведен сравнительный анализ протеома и профиля микроРНК контрольных экзосом и экзосом, полученных от резистентных сублиний. В целом в образцах экзосом было идентифицировано более 400 белков, из которых только 2 белка, DMBT1 (Deleted in Malignant Brain Tumors 1) и THBS1 (Thrombospondin-1), были гиперэкспрессированы в обоих типах резистентных экзосом (менее 5 % от общего количества белков, дифференциально экспрессированных в экзосомах резистетных клеток), что свидетельствует об уникальном составе экзосомальных белков для каждого типа резистентных клеток. Сравнительный анализ состава микроРНК, дифференциально экспрессированных в обоих вариантах экзосом резистентных клеток, выявил 180 гиперэкспрессированных микроРНК и 202 микроРНК с пониженной экспрессией. Среди них 4 гиперэкспрессированных и 8 гипоэкспрессированных микроРНК оказались ассоциированы с развитием гормональной резистентности клеток рака молочной железы. Биоинформатический анализ 4 гиперэкспрессированных микроРНК выявил 2 микроРНК, mir-101и mir-181b, участвующих в стимуляции PI3K сигналинга, свидетельствуя о важной роли последнего в развитии гормональной резистентности клеток рака молочной железы.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
На сегодняшний день влияние процессов аутофагии на канцерогенез остается не до конца изученным. С одной стороны, аутофагия является опухолевым супрессором за счет активации разрушения онкогенных протеинов, токсичных белков и дефектных органелл, которые могут обладать агрессивными свойствами и способствовать повреждению ДНК клетки. C другой стороны, аутофагия может способствовать выживанию опухолевых клеток в условиях гипоксии и присутствия активных форм кислорода, что происходит преимущественно за счет блокировки механизмов апоптоза, увеличивая шансы на поддержание циркуляции опухолевого клона. Регуляция аутофагии является сложным, многоэтапным и комплексным процессом. Основным его регулятором является сигнальный путь, который активирует белок протеинкиназосерин-треониновой специфичности m-Tor (мишень рапамицина у млекопитающих). В литературе имеются данные о влиянии белков аутофагии ATG5, LC3A и LC3B, Beclin-1 на способность злокачественно трансформированных клеток к выживанию, а также на развитие опухоли и ее прогрессирование. Крайне актуальными являются исследования, направленные на поиск возможных взаимосвязей между процессами аутофагии и патогенетическими механизмами канцерогенеза.
Цель исследования – изучить взаимосвязь экспрессионных параметров белков-регуляторов аутофагии m-TOR и Beclin-1 с параметрами лимфогенного метастазирования при колоректальном раке.
Материал и методы. В исследование были включены 105 пациентов с колоректальным раком T1–4N0–3M0,
находившихся на лечении в отделении торако-абдоминальной онкологии НИИ онкологии Томского НИМЦ в период с 2012 по 2015 г. Средний возраст больных составил 59,7±4,3 года. Морфологическая верификация диагноза колоректального рака проводилась на биопсийном материале фрагментов ткани первичной опухоли. Распространенность онкологического заболевания определялась согласно международной классификации по системе TNM (2002).
Результаты. Анализ частоты лимфогенного метастазирования в зависимости от наличия или отсутствия экспрессии белков m-Tor и Beclin-1 в цитоплазме опухолевых клеток выявил статистически значимую связь между этими параметрами.
Заключение. Полученные данные отчетливо демонстрируют тот факт, что снижение или утрата активности процессов аутофагии в опухоли сопровождается реализацией механизмов лимфогенной диссеминации, которая является предиктором неблагоприятного прогноза заболевания.
Для пациентов с выявленной наследственной мутацией E-cadherin-1 (CDH1) терапией выбора является профилактическая гастрэктомия для устранения риска развития рака диффузного типа. Представленный клинический пример описывает редкий случай наследственного рака желудка диффузного типа (HDGC), ассоциированного с мутацией в гене CDH1, впервые описанного в России. В 2013 году 28-летняя пациентка была поставлена на учет в клинической онкогенетической лаборатории с семейной историей рака желудка. Молекулярно-генетический анализ выявил наследственную мутацию в гене CDH1. Риск заболеть раком в течение жизни у пациентов с выявленной мутацией превышает 80 %. Гистологическое исследование биопсийного образца, полученного при эндоскопии, обнаружило изолированные мелко-круглые клетки в lamina propria. В отделе абдоминальной онкологии пациентке было проведено хирургическое вмешательство: лимфодиссекция в объеме D2 с сохранением селезенки и тотальная гастрэктомия с Roux-en-Y реконструкцией с формированием тощекишечного резервуара.
Цель исследования – оценить частоту встречаемости патогенных мутаций в BRCA1 гене у женщин с раком молочной железы, проживающих в России.
Материал и методы. Проведён анализ полной кодирующей части гена BRCA1 у 445 больных раком молочной железы на ранней стадии (возраст больных до 40 лет), проживающих в Новосибирской области (Россия), с помощью метода таргетного секвенирования на платформе Ion Torrent. Результаты. Выявлено 40 (9 %) носительниц различных патогенных мутаций. У 35 (7,9 %) пациенток обнаружена мутация 5382insC, описанная ранее как «мутация-основателя» в славянской популяции. У 5 (1,1 %) пациенток были выявлены другие различные патогенные мутации, а именно C61G, 462delCC, E143X, 4153delA и IVS18 + 1G> T. Кроме того, 29 генетических вариантов с отсутствующей или неясной клинической значимостью были обнаружены в гене BRCA1 у 445 больных раком молочной железы на ранней стадии. Выводы. Получены данные о частоте генетических вариаций гена BRCA1 у больных раком молочной железы на ранней стадии, проживающих в Новосибирской области (Россия). Доля мутации 5382insC составляет 87,5 % от всех патогенных мутаций в гене BRCA1, обнаруженных у пациенток.
Введение. Внутриопухолевая гетерогенность представляет собой характерную черту большинства злокачественных новообразований, в том числе и меланомы кожи. Данное свойство является одним из препятствий для проведения эффективной таргетной терапии, поскольку у различных субклонов опухолевых клеток наблюдается вариабельная чувствительность к данным препаратам. С современных позиций терапия злокачественных новообразований требует персонифицированного подхода для каждого конкретного пациента.
Цель исследования – оценка возможных различий между тканями меланомы, выделенными из различных участков первичной опухоли одного пациента на транскриптомном уровне.
Материал и методы. В работе были использованы культуры клеток меланомы, полученные из центральной и периферической частей первичной опухоли двух пациентов. Исследование транскриптомов клеток проводили методом микрочипирования с последующим биоинформатическим анализом.
Результаты. В клетках меланомы первого пациента, полученных из центрального и периферического участков одной опухоли, не было выявлено различий по транскриптомному профилю. У второго пациента имели место существенные различия (по 2953 транскриптам из 48226). В клетках, полученных из центрального участка опухоли, выявлено повышение мРНК генов, кодирующих белки, ассоциированные с иммунным ответом опухоли, транспортные белки ABC‑семейства, сигнальные молекулы класса цитокинов. В культуре клеток, выделенной из периферического участка этой же опухоли, зарегистрировано увеличение уровня мРНК генов, кодирующих белки внеклеточного матрикса и воспалительного ответа. В целом различия между субклонами клеток второго пациента касались ряда сигнальных каскадов, играющих ведущую роль в онкогенезе (MAPK, PI3K-Akt-mTOR, VEGFAVEGFR2 и др). Заключение. Проведенное исследование позволяет оценить возможные различия между клетками внутри опухоли на транскрипционном уровне с целью поиска новых подходов для персонифицированной терапии.
Введение. Эффективность противоракового лечения зависит от биологических факторов опухоли.
Цель исследования – определить активность протеасом и кальпаинов и выявить их связь с содержанием VEGF, HIF-1α и NF-κΒ в опухолевых, неизмененных и метастатических тканях карциномы почек (RCC).
Материал и методы. В исследование были включены 93 пациента с почечно-клеточным раком. Содержание транскрипционных факторов и VEGF определяли методом ИФА. Количественный состав протеасом исследовали методом Вестерн-блоттинг. Активность протеасомы и кальпаина определяли с использованием специфического флюорогенного субстрата.
Результаты. Выявлена инактивация протеолиза у пациентов с раком почки. Прогрессирование заболевания было связано со значительным снижением уровня клеточного протеолиза и ростом содержания транскрипционных и ростовых факторов в тканях первичной опухоли. Активация протеолиза была обнаружена в метастатических тканях.
Выводы. В результате проведенного исследования показано, что факторы транскрипции NF-κΒ, HIF-1α, VEGF и внутриклеточные протеолитические системы участвуют в прогрессировании рака почки.
Целью исследования явилось определение экспрессии CXCR4 в различных популяциях циркулирующих (ЦОК) и одиночных (дискретных) опухолевых клеток рака молочной железы.
Материал и методы. В исследование были включены 35 пациенток с инвазивной карциномой неспецифического типа молочной железы (T1–4N0–2M0) в возрасте от 29 до 69 лет. Экспрессию CXCR4 в различных популяциях ЦОК оценивали методом проточной цитометрии. Для оценки экспрессии CXCR4 в аналогичных популяциях одиночных (дискретных) опухолевых клеток в первичной опухоли использовали
метод конфокальной микроскопии.
Результаты. Нами было установлено, что CXCR4 экспрессировался ЦОК без признаков стволовости и эпителиально-мезенхимального перехода (ЭМП), ЦОК с признаками ЭМП, но без маркеров стволовости, а также ЦОК с признаками стволовости, но без признаков ЭМП. У всех пациенток в крови ЦОК с признаками стволовости и ЭМП не экспрессировался CXCR4. В первичной опухоли молочной железы CXCR4 обнаруживался как на одиночных (дискретных) опухолевых клетках без признаков стволовости с признаками ЭМП, так и на клетках с маркерами стволовости и ЭМП. У всех пациенток в образцах первичной опухоли отсутствовали стволовые и нестволовые клетки без признаков ЭМП.
Заключение. Таким образом, CXCR4 экспрессируются на различных популяциях ЦОК. Экспрессия CXCR4 не зависит от наличия или отсутствия признаков стволовости и/или ЭМП в опухолевых клетках. Также мы показали, что некоторые популяции одиночных (дискретных) опухолевых клеток в первичной опухоли характеризуются способностью презентировать на своей мембране CXCR4 и могут являться источником соответствующих популяций ЦОК.
Целью исследования явилась оценка возможности применения однофотонной эмиссионной компьютерной томографии (ОФЭКТ) с инновационным отечественным радиофармпрепаратом (РФП) 99mТс-1-тио-D-глюкоза (99mТс-ТГ) в диагностике и стадировании злокачественных лимфом.
Материал и методы. В исследование включены 15 пациентов (средний возраст 50,7±18,3 года) с впервые
диагностированными злокачественными лимфомами. Сцинтиграфическое исследование проводили на гамма- камере E.CAM 180 фирмы “Siemens” (Германия) через 4 часа после введения РФП в дозе 500 МБк.
Результаты. По данным ОФЭКТ, патологическое включение 99mТс-ТГ в лимфатические узлы наблюдалось у 14 (93 %) из 15 пациентов. У одной пациентки не удалось визуализировать определяемый с помощью компьютерной томографии (КТ) единичный, увеличенный поднижнечелюстной лимфатический узел. Этот ложноотрицательный результат исследования связан с физиологичным усилением аккумуляции 99mТс-ТГ в орофарингеальной области. Сложности, связанные с высокой фоновой активностью крови, отмечались при визуализации паратрахеальных, парааортальных и паракардиальных лимфатических узлов. Наиболее часто патологическое накопление РФП отмечалось в аксиллярных, над- и подключичных, а также шейных лимфатических узлах. С помощью ОФЭКТ с 99mТс-ТГ экстралимфатические гиперметаболические участки определялись у 7 (78 %) из 9 пациентов с ранее диагностированным экстранодальным поражением. Кроме того, у одной пациентки по данным ОФЭКТ был выявлен гиперметаболический очаг в легком, не обнаруженный по результатам КТ. В исследуемой выборке пациентов по данным КТ и ОФЭКТ с 99mТс-ТГ наличие поражения костного мозга наблюдалось в одном случае. Кроме того, сцинтиграфическое исследование позволило выявить гиперметаболические участки в лопатке у пациента с интактной по результатам КТ костной тканью.
Заключение. Результаты исследования позволяют рекомендовать использование 99mТс-ТГ ОФЭКТ в качестве дополнительного диагностического метода для обследования пациентов со злокачественными лимфомами для стадирования заболевания.
ОБЗОРЫ
Введение. Рак толстой и прямой кишки – разные опухоли с клинической и биологической точек зрения. В настоящее время рак толстой и прямой кишки синонимично называют колоректальным раком. Основываясь на нашем опыте в фундаментальных и клинических исследованиях в этой области, мы пришли к выводу, что термин «колоректальный рак» необходимо пересмотреть, его нельзя использовать как обобщающее понятие.
Материал и методы. Были проанализировали данные литературы и собственные результаты исследований, чтобы доказать или отклонить эту гипотезу.
Результаты. Выявлены следующие очевидные различия: риск развития рака прямой кишки в 4 раза выше, чем рака толстой кишки; молекулярный канцерогенез при раке толстой кишки отличается от рака прямой кишки; физическая активность помогает предотвратить рак толстой кишки, но не прямой кишки; существуют патогистологические различия между раком прямой и толстой кишки. Кроме того, имеются значительные клинические отличия между этими злокачественными новообразованиями, такие как различная хирургическая топография и объемы операций, разные показания для назначения комбинированного лечения, поскольку рак прямой кишки менее чувствителен к химиотерапии, чем рак толстой кишки, и отличаются прогностические факторы эффективности мультимодальной терапии (например, тимидилат синтетаза и дигидропиримидин дегидрогеназа).
Дискуссия. Рак толстой и прямой кишки определенно различаются по этиологии и формальному канцерогенезу, эффективности первичной профилактики, связанной с физической активностью, обычной и по параметрам молекулярной патологии. Согласно нашим данным, можно утверждать, что с доклинической точки зрения рак толстой и прямой кишки являются двумя разными опухолями, поскольку обладают различными репрезентативными биологическими характеристиками. Рак толстой и прямой кишки также существенно различаются по многим клиническим признакам, что было указано в отдельной статье, представленной нашей исследовательской группой. Заключение. Термин «колоректальный рак» не должен использоваться в фундаментальных и клинических исследованиях, как определение единого заболевания. Рак толстой кишки не одно и то же, что и рак прямой кишки. Злокачественные новообразования толстой кишки могут быть разделены на рак правой и левой половины ободочной кишки.
В обзоре проанализированы данные о роли хитиназоподобных белков (CLP), принадлежащих к семейству белков, содержащих Glyco_18 домен и не обладающих ферментативной активностью, при различных злокачественных новообразованиях. У человека идентифицировано 3 таких белка: YKL-40 (CHI3L1), YKL-39 (CHI3L2) и стабилин-связывающий CLP (SI-CLP). Хитиназоподобные белки, продуцируемые различными типами клеток, в том числе опухолевыми, проявляют активность как цитокины и ростовые факторы, а также они вовлечены в процессы воспаления. Высокий уровень CLP определяется в циркулирующей крови при воспалительных заболеваниях и разных локализациях злокачественных опухолей. Освещены данные о ключевых функциях CLP в физиологических и патологических условиях. Проанализированы сведения о вовлечении CLP в процессы инвазии, метастазирования, ангиогенеза, их связи с опухолевой прогрессией. Представлены собственные результаты, подтверждающие перспективность разработки прогностических и предсказательных маркеров на основе CLP при злокачественных новообразованиях.
ISSN 2312-3168 (Online)